Часть 2 — Кинетика коррозионного процесса
Часть 2 — Кинетика коррозионного процесса
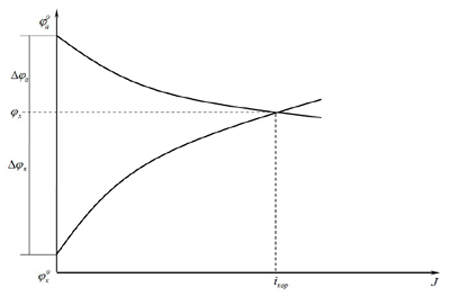
О кинетике коррозионного процесса принято судить по графической зависимости между смещением потенциала электрода и плотностью протекающего через электрод тока, так называемым поляризационным кривым. Чем более крутые поляризационные кривые, тем большая поляризационность у электрода, т.е. тем меньше скорость коррозионного процесса (рис.1).
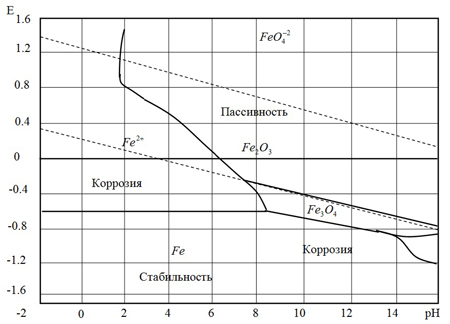
Коррозионное состояние удобно оценивать по диаграммам Пурбе (рис.2). На диаграммах приведена зависимость потенциала железа E от водородного показателя pH, характеризующего кислые и щелочные свойства раствора. В диаграммах можно выделить три возможные равновесия в системе железо — вода.
Рис.2 — Упрощенная форма диаграммы Пурбе для железа.
Равновесия, которые определяются только величиной потенциала, не зависят от pH (линии параллельны оси pH). В данном случае равновесие связано с обменом электрическими зарядами. Равновесия, определяемые только величиной pH и не зависящие от потенциала (линии параллельны оси потенциалов). Равновесия, зависящие как от потенциала, так и от pH (линии, величина наклона которых определяются характером конкретной электронной реакции).
Например, наклонная линия характеризует равновесие между ионами двухвалентного железа в растворе и твердой окисью железа, отражает условия возникновения твердых нерастворимых продуктов. Выше этой линии находится область пассивности, где металл термодинамически неустойчив, но коррозионный процесс не развивается благодаря образованию на его поверхности нерастворимых продуктов реакции, причём они должны образовываться непосредственно на реагирующей поверхности металла, так как вторичные продукты не могут его пассивировать. Пассивность металла (состояние относительной высокой коррозионной стойкости) происходит при торможении анодной реакции ионизации металла в определенной области потенциалов. Если металл находится в пассивном состоянии, коррозионные процессы не развиваются. Пассивное состояние металла, как правило, наступает при его контакте с некоторыми сильными окислителями или в щелочных средах.
Хотя металл, погруженный в электролит, является электродом, величина его абсолютного потенциала не поддается измерению. Поэтому потенциал металла принимают условно по отношению к водородному потенциалу — так называемый нормальный потенциал. Все металлы, согласно их нормальному потенциалу, образуют определенный ряд. Согласно этому ряду, нормальный потенциал железа E0 = 0,44 В, алюминия — 1,67 В, цинка — 0.763 В.
В жидких средах коррозия стали, определяется содержанием водородных ионов pH, а также наличием в среде депассивирующих ионов (типа хлор — иона). Водородный показатель pH является одним из основных характеристик активности водородных ионов. В чистой воде и нейтральных растворах pH = 7 (водородный показатель измеряется как отрицательный логарифм водородных ионов). Для кислых сред сильно возрастает активность ионов водорода (pH < 7), в щелочных — ионов гидроксида (pH > 7). Процесс коррозии затормаживается при значениях pH выше 9.
Вторым важным фактором (после водородного показателя) является наличие в воде кислорода, имеющего доступ к поверхности металла. В том случае, если кислорода в воде не содержится или он содержится в незначительном количестве, происходит торможение коррозионных процессов за счет водородной деполяризации. Когда кислород имеет свободный доступ к поверхности металла, он связывает водород (образующий защитный слой на поверхности железа) и способствует окислению двухвалентного железа в трехвалентное.
Гидроокись железа может переходить в различные гидратированные оксиды (называемые ржавчиной).
Оксиды представляют довольно рыхлые продукты, объем которых более чем в 2 раза больше, чем у железа.
В парогазовой среде коррозия зависит от толщины пленки влаги на поверхности и состава атмосферы. В условиях низких значений относительной влажности воздуха (до 40 — 50 %) пленка влаги, адсорбированная на поверхности, настолько тонкая, что, по существу, представляет переходное агрегатное состояние между твердым телом и жидкостью. А так как такая пленка не является электролитом, то отсутствует одно из условий, необходимых для протекания коррозии. Увеличение толщины пленки влаги на поверхности происходит по мере увеличения относительной влажности воздуха. Когда её толщина порядка микрометра и более, влага приобретает свойства «свободной воды», т.е. становится электропроводной. Процесс начинает развиваться при влажности воздуха около 70 — 75 % (рис.3).
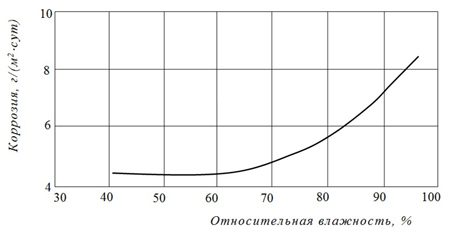 Рис.3 — Увеличение скорости коррозии стали с повышением влажности воздуха (по данным И.Л.Розенфельда)
Рис.3 — Увеличение скорости коррозии стали с повышением влажности воздуха (по данным И.Л.Розенфельда)
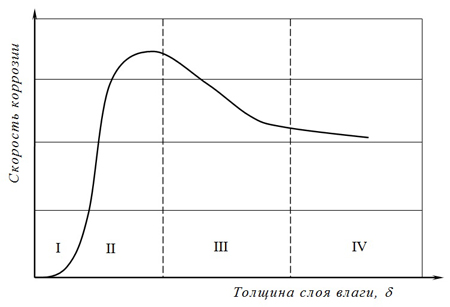
При наличии на поверхности холоднокатаной полосы, видимой невооруженным глазом влаги (дождь, брызги, конденсат и т.д.), а также когда холоднокатаная полоса погружена в воду, наблюдается «мокрая коррозия». В этом случае происходит некоторое уменьшение скорости растворения металла ввиду уменьшения доставки кислорода к его поверхности (рис. 4)
Рис.4 — Зависимость атмосферной коррозии от толщины слоя влаги на поверхности металла (по данным Н.Д.Томашова) I ― δ≈10―100 Å; II ― δ≈100 Å―1 мкм; III ― δ≈1 мкм―1 мм; IV―δ>1 мм
Все виды коррозии часто переходят из одной формы в другую, одинаково во всех случаях общая скорость коррозии определяется наличием на поверхности фазовой влаги и её составом. Повышение температуры увеличивает скорость коррозионных процессов, так как возрастает скорость диффузии кислорода (как деполяризатора) к поверхности, а также продуктов коррозии от поверхности, увеличивается скорость электрохимических реакций.
Для холоднокатаного проката хранящегося и транспортируемого при отрицательных температурах, процесс коррозии приостанавливается, так как в отличие от воды лед является диэлектриком, а поэтому не будет одного из необходимых условий коррозионного процесса — пленки электролита на поверхности металла. Часть 3 (заключительная)
Рекомендуем ознакомиться со статьями:
- Физика образования дефекта «Коррозия» на холоднокатаном прокате. Часть 1 — Факторы, влияющие на развитие коррозии
- Физика образования дефекта Коррозия на холоднокатаном прокате. Часть 3 — Влияние влажности на интенсивность коррозии
- Простое решение проблемы образования коррозии металла
- Декапирование перед лужением металла
- Выбор параметров эмульсии при холодной прокатке металла. Часть 1 — Содержание железа в эмульсии